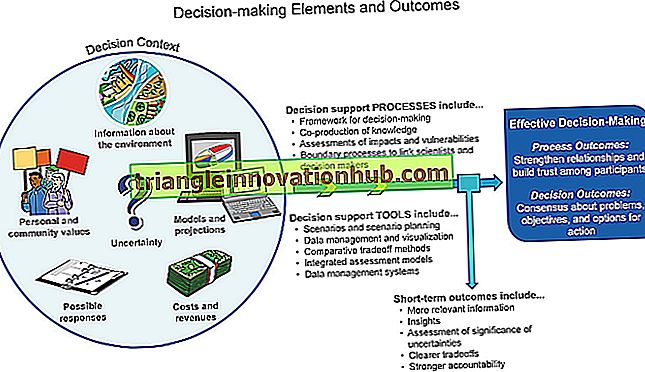
2 पूरक के सक्रियण के विभिन्न मार्ग
परिसंचरण में पूरक घटकों में से कई कार्यात्मक रूप से निष्क्रिय हैं। एक पूरक घटक के सक्रियण से दूसरे पूरक घटक की सक्रियता होती है।
सक्रिय दूसरा घटक तीसरे पूरक घटक पर कार्य करता है; अन्य पूरक घटकों की सक्रियता इस क्रमिक तरीके से जारी है। इस प्रकार पूरक प्रणाली की सक्रियता एक अनुक्रमिक कैस्केड जैसे फैशन के माध्यम से होती है (उदाहरण के लिए 9 पत्थरों को एक तरफ रखकर पहले पत्थर को धक्का दें। पहला पत्थर दूसरे पत्थर पर गिरता है और दूसरा पत्थर गिरने के लिए धक्का देता है। दूसरा पत्थर तीसरे पत्थर पर गिरता है। पत्थर, जो मुड़ता है 4 वें पत्थर पर गिरता है, और इसी तरह जब तक कि 9 वां पत्थर गिर न जाए।) (चित्र। 10.1)।

अंजीर 10.1 ए से सी: पूरक सक्रियण के कैस्केड जैसे फैशन का वर्णन करने के लिए एक उदाहरण।
(ए) नौ पत्थरों को कंधे से कंधा मिलाकर व्यवस्थित किया गया है। (ख) पहले पत्थर को धक्का दिया जाता है और वह गिरता है और दूसरे पत्थर को धक्का देता है। (C) पहले पत्थर के गिरने से अंततः अंतिम नौवें पत्थर के गिरने का परिणाम होता है
पूरक का सक्रियण दो अलग-अलग रास्तों से होता है:
मैं। पहले खोजे गए पूरक सक्रियण मार्ग को पूरक सक्रियण का क्लासिक मार्ग कहा जाता है।
ii। बाद में खोजे गए पूरक सक्रियण मार्ग को पूरक सक्रियण का वैकल्पिक मार्ग कहा जाता है। इन दो मार्गों के सक्रियण की दीक्षा के तंत्र अलग-अलग हैं। फिर भी, दोनों रास्ते पूरक घटक 3 (C3) की क्लीविंग की ओर ले जाते हैं। C3 दोनों रास्तों के लिए आम है और C3 की दरार के बाद होने वाली घटनाएँ दोनों रास्तों में समान हैं।
1. पूरक सक्रियण का क्लासिक मार्ग:
प्रतिजन में प्रतिजन में प्रतिरोपण या लक्ष्य कोशिका (जैसे सूक्ष्म जीव) पर प्रतिजन को बांधना क्लासिक पूरक मार्ग (चित्र। 10.2) की सक्रियता को प्रारंभ करता है। प्रतिजनों के प्रति एंटीबॉडी के बंधन एंटीबॉडी अणुओं के एफसी क्षेत्र पर C1q बाध्यकारी साइटों को उजागर करते हैं। पूरक घटक CI 3 प्रोटीन C1q, C1r और Clqr2S2 नामित है। C1q हिस्सा (CI का) एंटीजन-बाउंड एंटीबॉडीज पर C1q बाइंडिंग साइट्स को बांधता है।
↓
C1q को एंटीबॉडी से बांधना C1r में एक परिवर्तनकारी परिवर्तन को प्रेरित करता है। परिवर्तनकारी परिवर्तन C1r को एक सक्रिय एंजाइम में नामित C1r बनाता है।

Cir सी 1 क्लीवेज करता है। क्लीव्ड C1s एक सक्रिय एंजाइम है जो C1 का डिज़ाइन किया गया है।
↓
C1s बदले में दो पूरक घटकों, C4 और C2 को काटता है।
मैं। C4 को C4a और C4b अंशों में विभाजित किया जाता है। C4b टुकड़ा सूक्ष्म कोशिका की सतह से जुड़ जाता है।
ii। C2 घटक C4b से जुड़ता है। C4b से जुड़े C2 घटक को C1 द्वारा C2a और C2b अंशों में विभाजित किया जाता है। C2b टुकड़ा माइक्रोबियल सेल की सतह पर एक C4b2a कॉम्प्लेक्स छोड़कर दूर फैलता है।
↓
C3b2a C3 और C3b खंडों में C3 और क्लीवेज C3 पर जटिल कार्य करता है। (चूंकि जटिल C4b2a क्लीवेज C3 है, C4b2a कॉम्प्लेक्स को C3 कन्वर्टेज़ भी कहा जाता है।)
↓
C3b टुकड़ा C4b2a से जुड़ता है और C4b2a3b कॉम्प्लेक्स बनता है। (कुछ C3b अंश लक्ष्य कोशिका की सतह को बांधते हैं और लक्ष्य कोशिका के फैगोसाइटोसिस के लिए ओप्सिन के रूप में कार्य करते हैं।
↓
सी 5 बी और सी 5 बी में सी 4 बी 2 ए 3 बी जटिल क्लीवेज सी 5। (चूंकि C4b2a3b क्लीवेज C5, C4b2a3b कॉम्प्लेक्स को क्लासिक पाथवे C5 कन्वर्टेज़ कहा जाता है।) C5b का टुकड़ा माइक्रोब की सतह से बांधता है।
↓
C6 C5b को बांधता है और C5b6 जटिल बनाता है।
↓
C7 C5b6 से बांधता है और C5b67 कॉम्प्लेक्स बनाता है। C5b67 कॉम्प्लेक्स का हाइड्रोफोबिक क्षेत्र माइक्रोबियल सेल झिल्ली के फॉस्फोलिपिड्स से बांधता है और C5b67 कॉम्प्लेक्स माइक्रोबियल सेल झिल्ली में डाला जाता है।
↓
C8 C5b67 से जुड़ता है और C5b678 कॉम्प्लेक्स बनाता है। C5b678 कॉम्प्लेक्स माइक्रोबियल सेल झिल्ली में एक छोटा छिद्र (10-A व्यास) बनाता है।
↓
C9b6789 (n) जटिल बनाने के लिए C9 के कई अणु (10 से 17 अणु) एक C5b678 से जुड़ते हैं। C5b6789 (n) कॉम्प्लेक्स को मेम्ब्रेन अटैक कॉम्प्लेक्स (MAC) भी कहा जाता है। मैक कॉम्प्लेक्स माइक्रोबियल सेल मेम्ब्रेन (चित्र 10.3) पर छिद्र आकार को 70-100 ए तक बढ़ाता है। कई एमएसीएस पूरक सक्रियण के दौरान बनते हैं और प्रत्येक मैक सेल झिल्ली (चित्रा 10.4) पर एक छिद्र को छिद्र करने में सक्षम है। माइक्रोबियल सेल के अंदर उच्च आसमाटिक दबाव के कारण, बाहरी से पानी माइक्रोब में प्रवेश करता है। नतीजतन, माइक्रोबियल सेल सूज जाता है और फट जाता है (यानी माइक्रोब लाइस)।

अंजीर। 10.3: मेम्ब्रेन हमला जटिल ।
पूरक सक्रियण द्वारा गठित C5b6789 (n) कॉम्प्लेक्स को मेम्ब्रेन अटैक कॉम्प्लेक्स (MAC) भी कहा जाता है। मैक उत्पाद की तरह एक सिलेंडर है और यह कोशिका झिल्ली के एक छिद्र को छिद्रित करता है। सिलिंडर के माध्यम से जैसे कि कोशिका में और उसके बाहर छेद द्रव और अणु प्रवाहित होते हैं, जिसके परिणामस्वरूप कोशिका की मृत्यु हो जाती है

इस प्रकार प्रतिजन द्वारा व्यक्त माइक्रोबियल सेल के lysis में एंटीजन-बाउंड एंटीबॉडी परिणाम द्वारा क्लासिक पूरक पथ के सक्रियण। चूंकि शास्त्रीय मार्ग को एंटीबॉडी द्वारा शुरू किया जाता है, इसलिए शास्त्रीय मार्ग, अधिग्रहित प्रतिरक्षा प्रतिक्रियाओं में भूमिका निभाता है। एक सूक्ष्म जीव (जो शरीर में प्रवेश करता है) के खिलाफ विशिष्ट एंटीबॉडी की अनुपस्थिति में, क्लासिक पूरक पथ सक्रिय नहीं किया जाएगा (हालांकि आवश्यक सभी पूरक घटक शरीर में मौजूद हैं)।
पूरक सक्रियण के दौरान गठित अन्य पूरक टुकड़े (जैसे C4a, C3a, और C5a) में कई महत्वपूर्ण कार्य हैं और उन्हें बाद में वर्णित किया गया है (तालिका 10.2)।
पूरक सक्रियण का वैकल्पिक मार्ग:
शास्त्रीय पूरक मार्ग के विपरीत, वैकल्पिक पूरक मार्ग को सक्रियण के पूरक के लिए एंटीजन के खिलाफ एंटीबॉडी की आवश्यकता नहीं होती है। यह दर्शाता है कि प्रतिजन की पहली प्रविष्टि के दौरान भी वैकल्पिक मार्ग सक्रिय है। दूसरे शब्दों में, वैकल्पिक मार्ग एक सहज प्रतिरक्षा प्रतिक्रिया के दौरान सक्रिय होता है। जैसे ही रोगाणुओं ने मेजबान में प्रवेश किया, वैकल्पिक पूरक मार्ग रोगाणुओं के खिलाफ एक महत्वपूर्ण रक्षात्मक भूमिका निभाता है।
सी 3, फैक्टर बी, फैक्टर डी, और प्रॉफर्ड चार सीरम प्रोटीन हैं जो वैकल्पिक पूरक मार्ग के आरंभ में शामिल हैं (चित्र। 10.5; तालिका 10.3)।
C3 अणु में एक अस्थिर थाइस्टर बॉन्ड होता है। Thioester की अस्थिर प्रकृति के कारण C3 रक्त में सहज रूप से C3a और C3b में हाइड्रोलाइज हो जाता है। यदि कोई माइक्रोब सी 3 बी गठन की साइट के पास मौजूद होता है, तो सी 3 बी टुकड़ा माइक्रोबियल सेल सतह से जुड़ जाता है।
↓
फैक्टर बी सूक्ष्म जीव की सतह पर C3b को बांधता है।
↓
फैक्टर डी C3b बाध्य कारक बी पर दो टुकड़े, टुकड़ा बा और टुकड़ा बी बी का उत्पादन करने के लिए एंजाइमेटिक रूप से कार्य करता है। फ्रैगमेंट बा फैलता है और C3bBb कॉम्प्लेक्स बनता है। C3bBb कॉम्प्लेक्स में केवल 5 मिनट का आधा जीवन है। लेकिन एक अन्य सीरम प्रोटीन को उचित रूप से बुलाया जाता है जो C3bBb के आधे जीवन को 30 मिनट तक बढ़ाता है।
↓
C3bBb कॉम्प्लेक्स C3a और C3b अंशों का उत्पादन करने के लिए एक और C3 अणु को साफ करता है। (C3bBb कॉम्प्लेक्स को वैकल्पिक मार्ग C3 कन्वर्टेज़ कहा जाता है।) टुकड़ा C3b C3bBb से जुड़ता है और C3bB3b कॉम्प्लेक्स बनाता है।
↓
C3bBb3b जटिल क्लीवेज C5 को C5a और C5b (और इसलिए C3bBb3b को वैकल्पिक मार्ग C5 कन्वर्टेज़ के रूप में कहा जाता है)। बाद के पूरक सक्रियण चरण शास्त्रीय पूरक सक्रियण मार्ग के चरणों के समान हैं।


C6 C5b से जुड़ता है और C5b6 जटिल बनाता है।
↓
C7 C5b6 से बांधता है और C5b67 जटिल बनाता है।
↓
C8 C5b67 से जुड़ता है और C5b678 जटिल बनाता है।
↓
C9 के कई अणु C5b678 से बंधते हैं और C5b6789 (n) कॉम्प्लेक्स (मेम्ब्रेन अटैक कॉम्प्लेक्स) बनाते हैं। झिल्ली का हमला माइक्रोबियल सेल की दीवार में पंच छेद को जटिल करता है और माइक्रोबियल लसीका की ओर जाता है।

पूरक सक्रियकरण चरणों का प्रवर्धन:
रक्त में पूरक घटक कार्यात्मक रूप से निष्क्रिय अवस्था में होते हैं। पूरक घटकों में से कुछ प्रोएनजाइम हैं। जब प्रोएनजाइम को दो टुकड़ों में विभाजित किया जाता है, तो टुकड़ों में से एक एंजाइमी गतिविधि प्राप्त करता है।
पूरक सक्रियण के प्रत्येक चरण में गठित प्रत्येक एंजाइम अणु बाद के पूरक घटक के कई अणुओं पर कार्य करता है, जिसके परिणामस्वरूप कई पूरक घटकों की सक्रियता होती है। इस प्रकार प्रत्येक चरण पर सक्रिय किए गए पूरक घटकों की संख्या कई गुना बढ़ जाती है ताकि झिल्ली हमले परिसरों की भारी संख्या और अन्य पूरक टुकड़े उत्पन्न होते हैं, (उदाहरण के लिए एकल C3 कन्वर्ट अणु 200 C3 अणुओं पर कार्य कर सकता है और 200 C3b टुकड़े उत्पन्न कर सकता है।) विभिन्न चरणों में पूरक सक्रियण मध्यस्थता की रक्षा के लिए एक प्रभावी पूरक उत्पादन में मेजबान की मदद करता है।
क्लासिक पूरक पथ के गैर-प्रतिरक्षात्मक सक्रियण:
आमतौर पर, शास्त्रीय पूरक पाथवे सक्रियण की शुरुआत C1q के बंधन से होती है, जो पहले से ही प्रतिजन के लिए बाध्य एंटीबॉडी (यानी पूरक सक्रियण के क्लासिक मार्ग की दीक्षा प्रतिरक्षा आधारित है)। हालांकि, गैर-प्रतिरक्षाविज्ञानी साधनों द्वारा शास्त्रीय पूरक मार्ग सक्रियण भी शुरू किया जा सकता है।
मैं। कुछ बैक्टीरिया (जैसे Esch.coli और कुछ साल्मोनेला उपभेदों) और वायरस (जैसे कि पैरा इन्फ्लूएंजा वायरस और एचआईवी) सीधे Clq से जुड़ते हैं और पूरक सक्रियण शुरू करते हैं। क्लासिक मार्ग के इस तरह के गैर-प्रतिरक्षित सक्रियण को होस्ट करने के लिए उपयोगी हो सकता है) एक रोगाणु प्रतिरोधक प्रतिक्रिया के रूप में रोगाणुओं के खिलाफ कार्रवाई करने के लिए, और बी) एंटीबॉडी से रोगाणुओं को बांधने से पहले भी रोगाणुओं के खिलाफ कार्य करना।
ii। यूरेट क्रिस्टल, बैक्टीरियल एंडोटॉक्सिन, और हेपरिन भी गैर-प्रतिरक्षात्मक रूप से शास्त्रीय पूरक पाथवे सक्रियण शुरू कर सकते हैं।
2. पूरक सक्रियण के लेक्टिन मार्ग:
हाल ही में, पूरक सक्रियण के तीसरे मार्ग को 'पूरक सक्रियण का लेक्टिन मार्ग' कहा गया है। लेक्टिंस प्रोटीन होते हैं जो कार्बोहाइड्रेट से बंधते हैं। लेक्टिन पाथवे के चरण शास्त्रीय मार्ग के समान हैं सिवाय इसके कि लेक्टिन मार्ग को पूरक सक्रियण शुरू करने के लिए एंटीबॉडी की आवश्यकता नहीं होती है।
मन्नोज बाइंडिंग लेक्टिन (एमबीएल) तीव्र भड़काऊ प्रतिक्रियाओं के दौरान उत्पादित एक तीव्र चरण प्रोटीन है। MBL की संरचना C1q जैसी है। एमबीएल से जुड़े सेरिन प्रोटीज 1 और 2 (एमएएसपी -1 और एमएएसपी -2) नामक दो अन्य अणु पूरक प्रणाली के एमबीएल सक्रियण से जुड़े हैं। माना जाता है कि एमबीएल और एमबीएल से जुड़े सेरीन प्रोटीज को C1q, C1r और C1 के क्लासिक सप्लीमेंट पाथवे के रूप में कार्य करते हैं।
एमबीएल बैक्टीरिया कोशिका की सतह पर कार्बोहाइड्रेट अणुओं को बांधता है।
↓
फिर एमबीएल से जुड़े सेरीन प्रोटीज 1 और 2 सक्रिय होते हैं, जिससे सी 4 और सी 2 की दरार दिखाई देती है।
↓
इसके बाद के चरण शास्त्रीय पूरक सक्रियण के समान हैं।
हालांकि, लेक्टिन पाथवे के कई विवरण अभी तक ज्ञात नहीं हैं। चूंकि लेक्टिन मार्ग को सक्रियण के लिए विशिष्ट एंटीबॉडी अणुओं की आवश्यकता नहीं होती है, इसलिए यह सुझाव दिया जाता है कि पूरक सक्रियण का लेक्टिन मार्ग महत्वपूर्ण जन्मजात रक्षा तंत्रों में से एक हो सकता है। MBL नैदानिक रूप से महत्वपूर्ण बैक्टीरिया, वायरस, कवक और परजीवी की एक विस्तृत श्रृंखला को पहचानता है।
एमबीएल जीन के भीतर उत्परिवर्तन को एमबीएल, या एमबीएल-कमी के उप-इष्टतम प्लाज्मा स्तरों में परिणाम के लिए जाना जाता है। कई अन्य प्रतिरक्षा तंत्रों के अतिव्यापी कार्यों के कारण, एमबीएल के निम्न स्तर आम तौर पर प्रतिरक्षा-सक्षम व्यक्तियों में नैदानिक लक्षण पैदा नहीं करते हैं। लेकिन इम्यूनो-कॉम्प्रोमाइज़्ड मरीज़ों (जैसे कीमोथेरेपी पर कैंसर के मरीज़) में संक्रमण के लिए एमबीएल-कमी एक महत्वपूर्ण जोखिम कारक है।